近日,清华大学交叉信息研究院曾坚阳课题组与清华大学生命科学学院李丕龙课题组合作,系统性鉴定了SARS-CoV-2 N蛋白的相分离特性,深入探究了病毒RNA及复制相关蛋白参与N蛋白分相的情况,首次发现两个靶向N蛋白的小分子药物可以特异性干预N-viral RNA-nsp12复合物的相分离现象,进而提高其他抗病毒药物进入靶点的效率,最终提出基于相分离的抗病毒药物联合使用新策略。相关成果《深入理解N蛋白相分离为新冠肺炎提供新的治理策略》(Understanding the phase separation characteristics of nucleocapsid protein provides a new therapeutic opportunity against SARS-CoV-2)于3月26日在《蛋白质与细胞》(Protein & Cell)杂志上在线发表。
严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)引发的新冠肺炎(coronavirus disease 2019, COVID-19)疫情仍在全球肆虐。据世界卫生组织网站报道(https://covid19.who.int/),截至2021年3月下旬,新冠肺炎已造成全球223个国家和地区,1.26亿余人感染,276万余人死亡。面对这一突发的公共卫生安全事件,深入挖掘SARS-CoV-2的作用机制,探寻有效的干预靶点和治疗措施仍是当务之急,具有重要的现实治疗与防控意义。
在过去一年多时间里,人们对SARS-CoV-2的研究取得了很大进展,包括临床诊断、流行病学、病毒蛋白结构、分子进化机制、以及病毒与宿主互作等,但目前仍有大量问题亟待解决。作为冠状病毒中含量最丰富和最保守的结构蛋白,核衣壳(N)蛋白是一个重要的多功能蛋白质,不仅负责识别病毒RNA并将其包裹成螺旋对称的结构,从而将病毒基因组与外部环境隔离,而且能与病毒或宿主细胞中多种蛋白质相互作用,进而操控宿主细胞的多个信号通路,促进病毒RNA的复制和转录。
相分离(Phase separation)是生命科学领域近几年发展起来的研究热点。在一定条件下,溶液中的生物大分子会因相互作用而高度聚集浓缩,从普通溶液相中分离出来,形成独立的、粘稠的液体相(相分离液滴)。短短数月间,已有国内外的多个课题组报道了N蛋白能够与病毒RNA发生相分离这一现象[1-3]。由于N蛋白对病毒基因组的包装起着重要作用,作为一个关键的抗病毒靶点,N蛋白的相分离与之前广泛开展的小分子药物干预之间是否存在关联呢?
为解决这一疑问, 清华大学交叉信息研究院曾坚阳课题组与清华大学生命科学学院李丕龙课题组合作开展了相关研究[4]。研究人员首先通过IUPred2和PLAAC预测了N蛋白发生相分离的结构特性,并通过体外重构证实了其自身发生相分离的能力。进一步的体外相变实验表明,N蛋白与病毒特有序列UCUAA表现出较高的结合亲和力,从而形成更为稳定的相分离液滴,而完整的N蛋白结构对于其相分离也是至关重要的。此外,研究人员还通过体外实验证明了目前N蛋白上累积产生的部分高频突变也会影响N蛋白的相分离特性。

图1. SARS-CoV-2 N蛋白相分离特性的鉴定
已知SARS-CoV-2的复制是由Nsps蛋白为主的多亚基复制/转录复合物(RTC)共同介导的,而该复合物的核心组分是RNA依赖型RNA聚合酶 (RdRp)的催化亚基(nsp12),也是极为重要的病毒靶点之一。值得注意的是,N蛋白是目前唯一已知能自由穿梭病毒“复制工厂”并促进病毒RNA转录和复制的结构蛋白。研究者发现单独的nsp12蛋白在体外不能形成相分离,但它却能被招募进N蛋白驱动的相分离液滴中,且体外重构的RdRp复合物(nsp12-nsp7-nsp8)也能被招募其中,这为N蛋白参与病毒转录、复制提供了依据。
此外,研究人员前期基于人工智能的药物重定位框架筛选到了特异性靶向N蛋白的两个小分子(CVL218和PJ34)[5],体外实验证明CVL218和PJ34的加入会影响N-viral RNA-nsp12复合物的液滴大小及其内部流动性。研究人员猜测这一药物处理后“疏松”的液滴状态,可能会增加靶向nsp12蛋白的小分子(如瑞德西韦)对其靶点的可及性。随后,研究人员与其合作团队在细胞层面进行了活毒侵染实验,结果表明CVL218和瑞德西韦联合用药组在抗病毒效果上的确优于瑞德西韦单独用药组,一定程度上证明了上述假设。
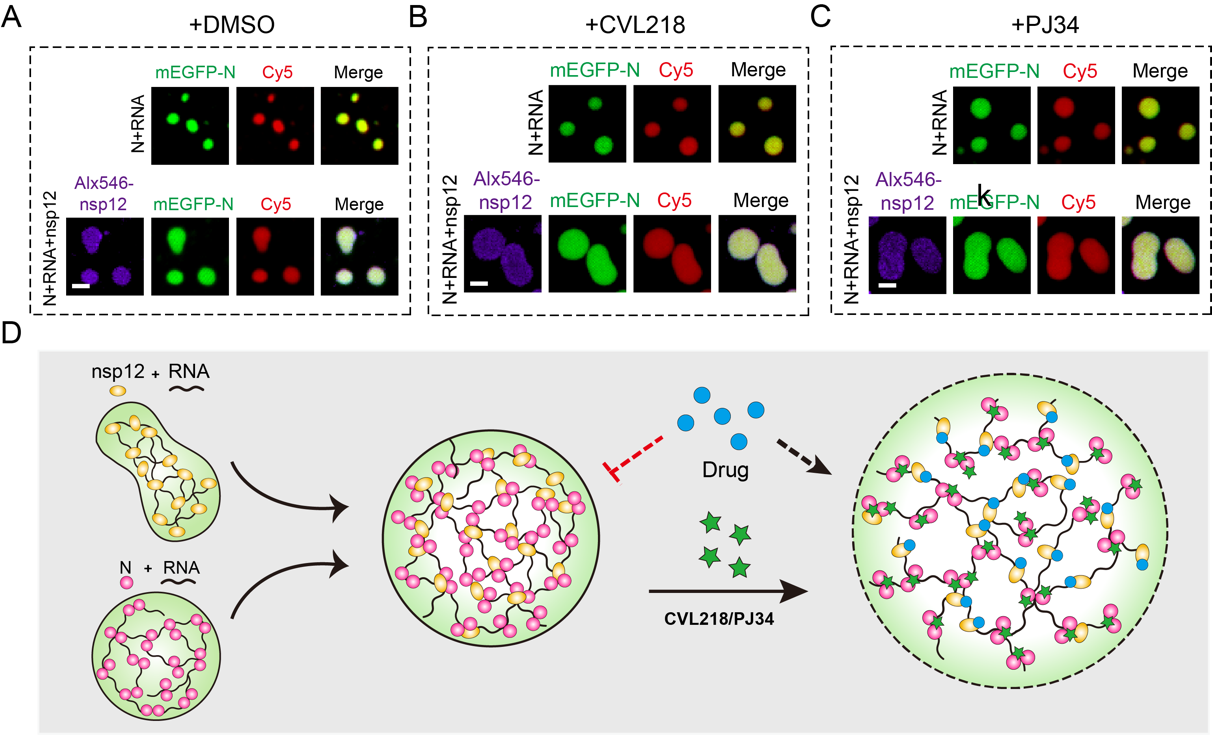
图2. CVL218和PJ34干预N蛋白相分离的作用示意图
综上所述,本研究系统性鉴定了SARS-CoV-2 N蛋白的相分离特性,首次发现靶向N蛋白的小分子CVL218和PJ34能够干预N-viral RNA-nsp12复合物的液滴形态及内部流动性,有效提高其他小分子药物进入病毒靶蛋白的效率,为后续新冠肺炎的治疗提出了基于相分离机制的联合用药新策略。
据悉,清华大学交叉信息研究院曾坚阳副教授与清华大学生命科学学院李丕龙研究员为本文的共同通讯作者;清华大学交叉信息研究院助理研究员赵诞、清华大学生命科学学院博士后许伟凡、清华大学交叉信息研究院博士后张晓凡为本文的共同第一作者。本研究还得到了清华大学医学院李海涛教授、江苏省疾病预防控制中心朱凤才教授团队、甫康(上海)健康科技有限公司沈孝坤博士、清华大学蛋白制备与鉴定平台、清华大学药学技术中心活性筛选平台的大力支持。此项研究工作获得国家自然科学基金面上基金、青年基金,南京图灵人工智能研究院和中关村海华前沿信息技术研究院支持。
原文链接:
https://link.springer.com/article/10.1007/s13238-021-00832-z
参考文献:
1. J. Wang, C. Shi, Q. Xu, H. Yin, SARS-CoV-2 nucleocapsid protein undergoes liquid-liquid phase separation into stress granules through its N-terminal intrinsically disordered region. Cell Discov 7, 5 (2021).
2. A. Savastano, A. Ibanez de Opakua, M. Rankovic, M. Zweckstetter, Nucleocapsid protein of SARS-CoV-2 phase separates into RNA-rich polymerase-containing condensates. Nat Commun 11, 6041 (2020).
3. C. Iserman et al., Genomic RNA Elements Drive Phase Separation of the SARS-CoV-2 Nucleocapsid. Mol Cell 80, 1078-1091 e1076 (2020).
4. D. Zhao et al., Understanding the phase separation characteristics of nucleocapsid protein provides a new therapeutic opportunity against SARS-CoV-2. Protein Cell, (2021).
5. Y. Ge et al., A data-driven drug repositioning framework discovered a potential therapeutic agent targeting COVID-19. bioRxiv, (2020)